Des molécules supplantant les anticorps
Des aptamères d’acides nucléiques et des protéines d’échaffaudage pourraient changer la façon dont les chercheurs étudient les processus biologiques et traitent les maladies.
Il y a de plus en plus de problèmes de rerproductibilité des résultats notamment par l’utilisation d’anticorps qu’ils soient polyclonaux ou monoclonaux. D’un lot à l’autre, les anticorps variernt dans leur spécificité, sans compter les réactions croisées.
Dans une étude de localisation des protéine shumaines en vue de constituer un Atlas, (1) la moitié des anticorps utilisés n’a pas confirmé leur spécifications tant en Western blot qu’en immuno-histochimie.
Malgré cela ; les anticorps monoclonaux, qui présentent beaucoup moins de variation de lot à lot que les anticorps polyclonaux, sont devenus l’outil d’affinité de choix en recherche.
Ils sont aujourd’hui couramment utilisés pour localiser des protéines dans les tissus, déterminer les interactions du réseau de protéines et analyser la fonction des protéines.
Ils ont atteint les limites de leurs performances dans des applications telles que les nano-immunoassays et l’imagerie cellulaire in vivo. En médecine, les anticorps thérapeutiques représentent le secteur le plus dynamique des ventes pharmaceutiques, avec 47 anticorps monoclonaux actuellement sur le marché et un autre 300 en essais 5 cliniques..
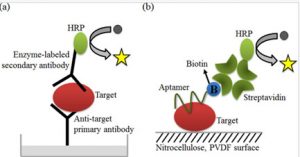 Aussi face aux problèmes de non-reprodctibilité des résultats, d’investissement en temps et en argent pour produire des anticorps et pour pallier le défaut de productions d’anticorps contre des substances toxiques ou peu immunogènes, des solutions de rechange ont élaborées telles que les aptamères d’acides nucléiques et des protéines d’échaffaudage (scaffold) pour cibler spécifiquement des cibles protéiques aussi bien en recherche qu’en application clinique.
Aussi face aux problèmes de non-reprodctibilité des résultats, d’investissement en temps et en argent pour produire des anticorps et pour pallier le défaut de productions d’anticorps contre des substances toxiques ou peu immunogènes, des solutions de rechange ont élaborées telles que les aptamères d’acides nucléiques et des protéines d’échaffaudage (scaffold) pour cibler spécifiquement des cibles protéiques aussi bien en recherche qu’en application clinique.
Les aptamères sont de courtes molécules d’ADN simple brin ou d’ARN, typiquement de moins de 100 nucléotides, qui forment des structures
Figure : Aptamère utilisé en lieu et place d’un anticorps a), ELISA : b), ALISA
3D capable de se lier spécifiquement à des protéines cibles. Les échafaudages protéiques, formés à partir de fragments de polypeptides ou de protéines entières, ont des affinités pour les molécules cibles.
Les deux types de réactifs d’affinité, sont produits entièrement in vitro, donc, en principe, ils ne sont pas soumis aux limitations de la production d’anticorps par les systèmes immunitaires des animaux, ce qui permet aux chercheurs d’étudier les protéines pour lesquelles il est impossible de générer des anticorps.
De PM plus de 10 fois moindre que celui des anticorps (150 kDa) , ces 2 types de réactifs peuvent se fixer sur des epitopes inaccessibles aux anticorps. Grâce à leur petite taille ils pénètrent les tissus et les cellules ; ils pourraient donc délivrer des médicaments directement dans les cellules ; utilsés en immuno-histochimie, couplés à un indicateur ils offrent un marquage cellulaire plus précis et diminuent les résultats faussement négatifs des anticorps. Injectés, ils sont plus rapidement éliminés du corps, ce qui en fait des agents d’imagerie idéaux en clinique.
 Des aptamères sont maintenant générés qui résistent aux pH et aux nucléases et qui offrent uen diversité accrue ; et les protéines–échaffaudage sont générées sans cystéine ce qui réduit les possibilités de repliement intra cellulaire.
Des aptamères sont maintenant générés qui résistent aux pH et aux nucléases et qui offrent uen diversité accrue ; et les protéines–échaffaudage sont générées sans cystéine ce qui réduit les possibilités de repliement intra cellulaire.
Surtout, les aptamères d’acides nucléiques et de protéines d’échaffaudage sont beaucoup plus faciles à reproduire que des anticorps, soit par synthèse chimique soit encore par expression dans des bactéries et peuvent souvent être à la disposition des chercheurs en quelques semaines.
Figure ci-dessus montrant une protéine échaffaudage (rouge) générée spécialement en quelques jours pour fixer un ligand d’intérêt (vert) et une étiquette fluorochrome ou autre (étoile jaune) servant à le repérer ou à le purifier.
Comme ils ne sont pas immunogènes ils intéressent de nombreuses entreprises thérapeutiques dont certaines ont déjà lancé les phase 2 et 3 d’ essais cliniques notamment dans la dégénérescence (2) maculaire liées à l’âge . Administré directement dans l’œil, cet aptamère se lie sélectivement à l’isoforme le plus courant responsable de la croissance de l’endothélium vasculaire (VEGF), ce qui empêche l’angiogenèse et l’accroissement de perméabilité des vaisseaux sanguins.
Les aptamères d’acides nucléiques et des protéines d’échafaudage peuvent également aider à lutter contre les épidémies émergentes de maladies infectieuses aiguës grâce aux nombreuses banques dont on dispose.
Enfin les réactifs d’affinité ont la capacité de cibler spécifiquement des isoformes et des glycoformes de protéines individuelles, et ainsi marquer spécifiquement toutes les protéines dans une cellule ou un organisme.
C’est donc une voie qui pallie le défaut de reproductibilité des résultats des anticorps.
Plus de renseignements,
Antibody Alternatives , Jane McLeod et Paul Ko Ferrigno | 1 février 2016 ; The Scientist
1. L. Berglund et al., “A genecentric Human Protein Atlas for expression profiles based on antibodies,” Mol Cell Proteomics, 7:2019-27, 2008
2. P. Sundaram et al., “Therapeutic RNA aptamers in clinical trials,” Eur J Pharm Sci, 48:259-71, 2013
